Почему йодоводородная кислота сильнее фтороводородной

Химические свойства кислот
Что делает кислоту сильной или слабой? Чтобы ответить на этот вопрос, нам сначала нужно взглянуть на определение кислоты. Следовательно, уровни кислотности кислоты зависят от ее способности диссоциировать ионы водорода, то есть чем больше число ионов водорода, продуцируемых кислотой в растворе, тем более кислым он является. Теперь, прежде чем мы перейдем к списку сильнейших кислот на Земле, есть определенные термины и определения, с которыми вам необходимо ознакомиться. Константа диссоциации кислоты K a : иногда известная как константа ионизации кислоты или просто кислотная константа - это количественно выраженная сила кислоты в водном растворе. Это подводит нас к другому связанному и важному показателю кислотности pK a.
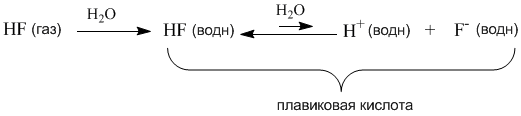
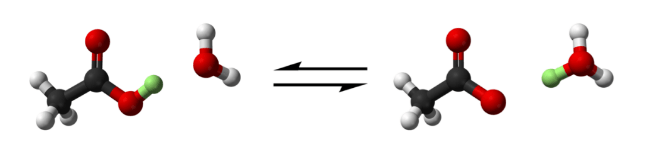




Как же я ждала момента, когда напишу эту статью. Теперь она готова! Вот Вам сразу табличка с кислотами.

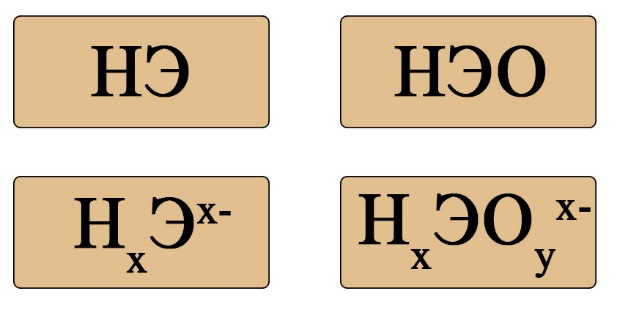
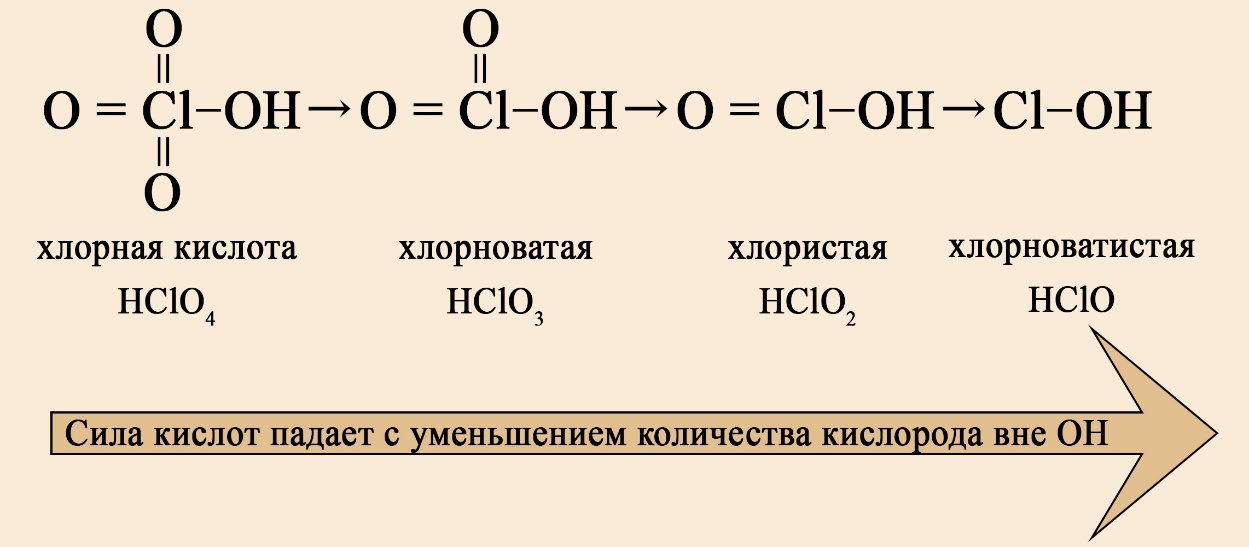
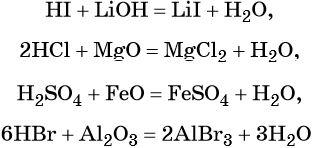

Важен не только состав, но и последовательность. На первом месте должен стоять водород, за ним — элемент, если в составе есть кислород, то он должен стоять последним. Например, HCl — кислота соответствует формуле HЭ , H 2 S — тоже кислота на первом месте водород, на втором - сера , а вот NH 3 несмотря на то, что состоит из водорода и элемента, не является кислотой, это легко определить по последовательности: в этой формуле сначала стоит элемент, а за ним — водород иногда, чтобы запутать сдающего, составитель может написать не NH 3 , а H 3 N, Вы должны помнить, что NH 3 аммиак , PH 3 фосфин , AsH 3 арсин , CH 4 метан — не являются кислотами, так как в воде либо не диссоциируют, либо диссоциируют без образования протона водорода. Кислоты можно разделить на кислородсодержащие и бескислородные.